
Los Animales de Laboratorio No Tradicionales (ALNT) y su importancia en la Investigación Biomédica (Parte II)
Articulos Cientificos Noticias 01 March 2020El Armadillo Chaetophactus villosus como modelo biológico no tradicional. Parte II
Los Animales de Laboratorio No Tradicionales (ALNT) y su importancia en la Investigación Biomédica.
El Armadillo Chaetophactus villosus como modelo biológico no tradicional. Parte II
Omar H. Iodice y Claudio Cervino.
Instituto de Fisiología y Neurociencia (IFiNe).
Secretaría de Ciencia y Tecnología. Universidad de Morón.
Resumen
La elección de un adecuado modelo experimental suele ser el factor decisivo entre el éxito o el fracaso de un experimento. Los animales de experimentación no tradicionales suelen resolver problemas que hasta ese momento resultaban de difícil solución. Tal es el caso de los Armadillos.
Se destaca la particular ubicación filogénica de estos animales, lo que refuerza la importancia de su estudio pormenorizado.
Se detallan numerosas aplicaciones en la investigación biomédica que confirman lo antedicho en especial para Chaetophractus villosus (peludo). Un género estrictamente sudamericano.
Se ratifica su consideración como Animales de Laboratorio No Tradicionales (ALNT) debido a las siguientes características sobresalientes: a) poseer una vida de larga duración que permite realizar estudios de enfermedades crónicas; b) ser susceptibles a infecciones y otras manipulaciones experimentales para las que no se poseía un animal experimental adecuado; c) ser reservorio de enfermedades endémicas de interés nacional.
Palabras clave:
Chaetophractus villosus. Armadillos. Animales de Laboratorio No Tradicionales (NTLA). Modelos experimentales.
Non-Traditional Laboratory Animals (NTLA) and their importance in Biomedical Research.
The Armadillo Chaetophactus villosus as a non-traditional biological model. Part II
Summary
The choice of an adequate experimental model is usually the decisive factor between the success or failure of an experiment. Non-traditional experimental animals usually solve problems that until then were difficult to solve. Such is the case of the Armadillos.
The particular phylogenetic location of these animals stands out, which reinforces the importance of their detailed study.
There are numerous applications in biomedical research that confirm the aforementioned especially for Chaetophractus villosus (Large hairy armadillo). An only South American genre.
It consideration as Non-Traditional Laboratory Animals (NTLA) is ratified due to the following outstanding characteristics:
a) To have a long life that allows studies of chronic diseases;
b) Be susceptible to infections and other experimental manipulations for which a suitable experimental animal was not possessed;
c) Be a reservoir of endemic diseases of national interest.
Keywords
Chaetophractus villosus. Armadillos. Non-Traditional Laboratory Animals (NTLA). Experimental models.
Introducción
Existen variadas razones para encarar la crianza de especies silvestres bajo condiciones de cautividad. Una de ellas es la utilización de las mismas como modelos experimentales para diversas investigaciones biológicas, básicas y aplicadas. Una apropiada elección del modelo animal ha permitido optimizar los recursos en juego, tanto humanos como materiales. El mejoramiento de los sistemas de cría y la utilización de estos animales en diversas áreas de la investigación hace que se conviertan en Animales de Laboratorio No Tradicionales (ALNT). Entre éstos merecen destacarse unos mamíferos muy particulares: los Armadillos¹.
Tomando en cuenta los principios enunciados en la Parte I, avanzaremos un poco más en el conocimiento de este conspicuo grupo animal.
Un poco de historia…
Los naturalistas que llegaron a estas tierras estudiaron con gran curiosidad a los armadillos. Nos enteramos sobre estos animales en los dibujos y descripciones del jesuita inglés Tomás Falkner y en la monumental obra zoológica de José Sánchez Labrador sobre la fauna rioplatense, tucumana y paraguaya, así como con los trabajos del ilustre Félix de Azara.
Los edentados, entre los cuales están los armadillos, contribuyeron a inspirar a Darwin en el desarrollo de su teoría referente a los mecanismos de la evolución. En efecto, el naturalista inglés encontró en las pampas de Sudamérica restos fósiles de grandes mamíferos cubiertos por armaduras óseas, como las de los armadillos vivientes de los mismos sitios. Esto fue para Darwin particularmente sugestivo, pues si las especies vivientes mostraban afinidad con especies extintas, no había razones para desdeñar que los tipos extintos hubiesen dado origen a los vivientes.
Pero los armadillos adquieren gran importancia en las ciencias biomédicas a principios de la década de 1970 cuando se descubre su susceptibilidad al Mycobacterium leprae y el posterior desarrollo de lepromas bacilares comparables a los de los humanos (Storrs, 1971; Kirchheimer y Storrs, 1971; Storrs et al., 1974; Kirchheimer, 1976).
Sin embargo, ya a principios del siglo XX llamó la atención de los investigadores otra característica biológica de algunos miembros de este grupo de mamíferos: la poliembrionía específica del género Dasypus; siendo el argentino M. Fernández (1909) pionero en este tema (Fig. 1).
¹Parte de la información presentada a continuación pertenece a las Tesis Doctorales:
• Cervino, CO. 1997. “Estudio cuantitativo de dos nuevos ritmos bioeléctricos de los bulbos olfatorios registrados en el armadillo sudamericano Chaetophractus villosus (Mammalia, Dasypodidae)” (MS). Tesis Doctoral, Fac. de Cs. Exactas y Naturales, Universidad de Buenos Aires.; y
• Iodice, OH. 2010. “Armadillos y Zarigüeyas como Modelos Experimentales en la Investigación Biomédica: Contribuciones a la Generalización de su Uso” (MS). Tesis Doctoral de la Universidad de Morón.

Figura 1.
Fotografía donde se observa la disección del útero de un ejemplar del género Dasypus con preñez casi a término. Puede identificarse los cordones umbilicales de las crías, todos provenientes de un mismo saco placentario (Instituto de Neurociencia, CONICET-UBA).
En este contexto, es a partir de mediados del siglo XX cuando comienza a desarrollarse el interés y las técnicas para criar a este grupo de mamíferos en condiciones de cautividad y con fines experimentales (Talmage y Buchanan, 1954; Anderson y Benirschke, 1966; Storrs y Greer, 1973).
También en la década de 1970, destacados investigadores de Sudamérica se encuentran abocados al estudio experimental de la Enfermedad de Hansen en armadillos. Es el caso de los equipos de investigación del Dr. Convit en Venezuela (Convit y Storrs, 1975) y del Dr. Baliña (Baliña et al., 1985) en Argentina. Si bien en la actualidad no es tan amplio el número de publicaciones al respecto, sigue siendo motivo de investigación el papel epidemiológico de los Armadillos en la diseminación de la Enfermedad de Hansen. Sobre todo en lo referido a la manipulación y el consumo de estos animales.
En nuestro país, Argentina, como hemos hecho referencia en la Parte I, tenemos que mencionar al Dr. Jorge M. Affanni como un pionero en el uso del Armadillo como modelo experimental. En la década de 1960, antes que el género Dasypus cobrara importancia en el estudio del Mycobacterium leprae, el Dr. Affanni ya utilizaba a este grupo animal como modelos en neurobiología. Desde la dirección del Instituto sobre Marsupiales y Edentados (INIMAYDE, CONICET-UBA), su continuidad el Instituto de Neurociencia (INEUCI, CONICET-UBA) y por último el Instituto de Neurociencia de la Universidad de Morón, el Dr. Affanni y sus colaboradores, han sido pioneros en utilizar Armadillos como modelos experimentales en neurobiología, neurofisiología y psicología experimental (Affanni et al., 1968). Varias publicaciones provenientes de dicho grupo de investigación han confirmado el uso de este grupo animal como modelo biológico experimental (Iodice, 1987; Iodice y Affanni, 1986; 1988). Del mismo modo, un considerable número de Tesis Doctorales, utilizando al Armadillo como modelo experimental, han surgido de los señalados centros de investigación (García Samartino, 1983; Casanave, 1989; Aldana, 1996; Cervino, 1997; Ferrari, 1997; Carmanchahi, 2000; Iodice, 2010).
Un poco de prehistoria…
Los Armadillos eran llamados antiguamente “Desdentados”, tomando en cuenta que algunas especies del grupo tenían las mandíbulas atrofiadas y carecían de piezas dentarias. Dado que esta característica no era generalizada en todos los integrantes del grupo, la denominación cayó en desuso.
También se los clasificó tradicionalmente bajo el nombre ordinal de Edentata en el cual se incluían además a los pangolines y al cerdo hormiguero africano. La sistemática actual ubica a los primeros en Pholidota y al segundo en Tubulidentata, separándolos por consiguiente de los Armadillos.
Más recientemente se los clasifico dentro de los Xenarthra, conformando un conjunto heterogéneo de mamíferos euterios exclusivamente americanos, que constituye sin duda, uno de los grupos más característicos de la fauna neotropical (Fig. 2) (sólo una especie, Dasypus novemcinctus, excede su límite norte al instalarse en México y sur de EE.UU.)
El grupo está compuesto por varias familias y géneros, todos provistos de extremidades robustas y uñas muy desarrolladas que se encuentran adaptadas las necesidades establecidas por los hábitos cavícolas o arborícolas según las especies de que se trate.
El término “xenartros” se refiere una característica anatómica consistente en que en la columna vertebral, en los arcos de las vértebras lumbares y en algunos casos también de las dorsales, existen cigapófisis accesorias para cada una de las correspondientes articulaciones (Cabrera y Yepes, 1940).
La ruptura de las relaciones geográficas entre ambas Américas en los comienzos del Cenozoico, hace más de 60 millones de años, dio origen a un gran continente-isla y dejó aislados a los primeros mamíferos inmigrantes. De esta fauna derivan los Xenartros, que se originaron en América del Sur y que nunca salieron del continente americano.
Este semiaislamiento del continente sudamericano se tradujo en un número importante de subfamilias y el grupo alcanzó un notable incremento en número y diversificación.
Pero a finales del Pleistoceno (hace 2 o 3 millones de años), casi todas las subfamilias se habían extinguido por causas probablemente diversas: predación por especies carnívoras provenientes del Norte, modificaciones climáticas y la llegada de los humanos (Patterson y Pascual, 1968).
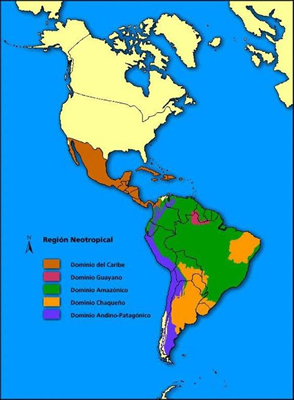
Figura 2.
Mapa que indica la Región Biogeográfica Neotropical.
(Tomado de: Regiones Biogeográficas Continentales https://surdelsur.com/es/regiones-biogeograficas-argentinas/)
El origen antiguo y el aislamiento geográfico llevaron al grupo de los Xenartros a una temprana especialización para tipos de vida muy determinados que enmascararon las características que poseían de sus antepasados. Los integrantes de este grupo evolucionaron en dos líneas de radiación adaptativa: los osos hormigueros y los perezosos por un lado, y los armadillos por el otro.
La denominación actual de Xenarthra corresponde a un Superorden que abarca a los perezosos, osos hormigueros y armadillos (McKenna y Bell, 1997).
Este Superorden se divide a su vez en dos Órdenes:
• Pilosa (perezosos y osos hormigueros) y
• Cingulata (armadillos).
El orden Cingulata posee una sola familia:
• Dasypodidae, que incluye a los armadillos, siendo el Chaetophractus villosus uno de sus miembros y objeto del presente trabajo.
Los Cingulata (Armadillos), se cuentan entre los grupos más representativos de mamíferos cenozoicos sudamericanos. Su batería dentaria se caracteriza por la homodoncia, la hipselodoncia y la ausencia de esmalte en la casi totalidad de las formas conocidas. Se ha propuesto que estas peculiaridades se relacionan con una adaptación primigenia a la insectivoría y representan una fuerte señal filogénica que restringió, o al menos condicionó, la adaptación a otros tipos de hábitos alimentarios. Sin embargo, la gran diversidad de formas registradas sugiere un abanico de posibilidades adaptativas que abarca desde mirmecófagos especializados hasta carroñeros o predadores, entre las formas animalívoras; y desde ramoneadores selectivos hasta pastadores que se alimentan al bulto, entre las herbívoras, e incluye formas omnívoras (Vizcaíno et al., 2004).
La familia Dasypodidae comprende en la actualidad 9 géneros vivientes que abarcan 21 especies (Wilson y Reeder, 1993). Dado que el orden tiene una sola familia, ésta también recibe el nombre común de Armadillos. En el caso de las numerosas especies, reciben diversos nombres vulgares, siendo predominantes los que tienen su origen en lenguas aborígenes.
Ocupan una gran variedad de nichos ecológicos, encontrándose perfectamente adaptados a los mismos. Con respecto a la distribución actual del grupo, se considera que existiría cierta relación entre el tamaño corporal y las características climáticas, dadas que las especies de mayor tamaño corporal son estrictamente tropicales (McNab, 1980 y 1985). Otro factor que afecta la distribución de este grupo es la disponibilidad de agua, pues las condiciones de aridez afectan seriamente a algunos géneros (Clark, 1951; Humphrey, 1974); en el caso de C. vellerosus, por el contrario, se encuentra perfectamente adaptado al ambiente desértico debido, en parte, a la eficiencia de su riñón “xérico” (Greegor, 1975).
Un poco de biología…
♦Aspecto externo
El orden Cingulata son mamíferos plantígrados, unguiculados, con pilosidad dispersa. Son de tamaño variable según la especie, de extremidades robustas y provistas de uñas muy desarrolladas adaptadas a los hábitos cavícolas (Cabrera y Yepes, 1940; Walker, 1968). Una característica distintiva de este grupo es la presencia de oscículos dérmicos en la piel conformando caparazón y escudetes. La presencia de formaciones óseas dérmicas es característica distintiva de los Armadillos y Griptodontes (grupo prehistórico extinguido), pero también se demostró en algunos perezosos fósiles (Engelmann, 1985), constituyéndose en una prueba importante de la unidad filogenética del grupo.
Los Dasipódidos actuales son animales de tamaño mediano a moderadamente grande, oscilan entre 15 cm y 150 cm de longitud (Wetzel, 1985) y 125 g a 60 kg (McNab, 1980) correspondiendo los valores extremos a Chlamphorus truncatus y Priodontes maximus, respectivamente.
Se caracterizan externamente por la presencia de un caparazón formado por placas más o menos aplanadas, derivadas de los osículos dérmicos, que constituyendo un mosaico de placas dérmicas yuxtapuestas, córneas y óseas. Este caparazón posee una serie de bandas móviles en la zona dorsal en un número variable (entre 3 y 30) según la especie y con diverso grado de flexibilidad. En los extremos craneal y caudal de esta zona flexible se encuentran dos conjuntos de placas o bandas fijas ente sí, que conforman los escudos escapular y pelviano respectivamente. Dichas bandas y la convexidad adecuada de los escudos, permiten al animal mover y doblar el cuerpo evitando la rigidez del caparazón a nivel medio-dorsal.
Poseen un escudete cefálico triangular. Las orejas son medianas y se ubican lateralmente. La nariz puede ser corta o larga dependiendo de la especie.
El escudo pelviano es levemente convexo y posee 2 o 3 orificios correspondientes a las glándulas pélvicas ubicados en el tercio caudal del escudo sobre la línea media dorsal
La cola está recubierta por placas anilladas; pequeñas placas protegen, además, las partes expuestas de los miembros.
La piel es resistente, con pelaje relativamente largo, duro y generalmente ralo, revistiendo las partes blandas del cuerpo. En el caparazón los pelos son cerdosos y comúnmente escaso, excepto en la especie denominada “pichi ciego” (Chlamyphorus truncatus) que son suaves y sedosos (Yepes, 1928).
♦Morfología interna
El cráneo de los Dasipódidos tiende a ser relativamente elongado. Presencia de un pequeño hueso nareal, característica netamente reptiliano, que en los mamíferos solo se encuentra en este grupo (Grasse, 1955). Se caracterizan por una fuerte regresión dentaria, con una tendencia marcada al monofiodentismo y a la homodoncia. Incisivos y caninos verdaderos ausentes, premolares y molares tubulares (Grasse, 1955; Silva Sasso y Della Serra, 1965; Cabrera, 1973). Los dientes no presentan esmalte en los adultos.
Presentan como rasgo distintivo, típicas apófisis (cigapófisis) accesorias (xenarthrales) en las vértebras dorsales y lumbares; de ahí el nombre de xenartros o “animales de articulaciones extrañas”. Esto determina la presencia de una, dos ó tres pares de facetas articulares suplementarias en las caras anterior y posterior de las respectivas vértebras. Las articulaciones isquiáticas (también las del ilium) con la columna vertebral otorgan al extremo posterior de la misma una rigidez inusual (Frechkop y Yepes, 1949; Frechkop, 1950). Estas características a las que debe agregarse la presencia de poderosos miembros posteriores, permiten al grupo adoptar la posición erecta, sobre un “trípode” constituido por los miembros posteriores y la cola (Wetzel, 1982).
Otra característica excepcional es el número de vértebras cervicales (entre 6 y 10), encontrándose en ocasiones fusión de dos o más. Comúnmente poseen 11 vértebras dorsales y 5 lumbares (Beddard, 1909).
La estructura anatómica del cerebro de este grupo ha sido objeto de varios estudios (Benitez et al., 1994). El cerebro presenta escasos pliegues y circunvoluciones (lisencefalia), pudiendo describirse desde el punto de vista macroanatómico, como relativamente simple. Gran desarrollo relativo de las áreas basales y rinencefálicas de los hemisferios cerebrales -telencéfalo macrosmático- (Gervais, 1869).
Glándula pineal ausente o muy poco desarrollada (Ralph et al., 1979). La hipófisis en los xenartros tiene características anatómicas peculiares; por ejemplo, Dasypus novemcinctus tiene una pars tuberalis típica, pero no posee pars intermedia (Wislocki, 1938).
Retia mirabila en los miembros (Wislocki y Enders, 1935; Grasse, 1955) y glándulas salivales voluminosas (Shackelford, 1963).
Se encontró gran similitud cariotípica entre perezosos y armadillos, si bien los primeros presentan cromosomas supernumerarios, poco comunes en mamíferos (Jorge et al, 1985).
Los testículos son intrabdominales y se ubican en el pliegue del peritoneo (Wislocki, 1933). El útero es una cámara simple, presentando a veces dos cuernos cortos (Galbreath, 1985). La placenta es típicamente euteria, corion-alantoidea hemocorial, primero difusa y luego discoidal; en el género Dasypus se modifica por la poliembrionía específica (Enders, 1960). Las mamas son pares, pectorales o abdominales, raramente inguinales, en número de dos a cuatro.
Los Dasipódidos se caracterizan por la presencia de un conjunto de otras particularidades anatómicas peculiares, entre las cuales pueden citarse: ausencia del foramen rotundum, desarrollo de una carena lateral en la zona de la tróclea humeral que articula con el radio, fuerte desarrollo del trocánter mayor del fémur, fusión del axis con una o más vértebras cervicales, tibia y peroné fusionados distal y proximalmente, hueso lagrimal triangular, expandido anteriormente, proceso ventral del yugal reducido y foramen óptico próximo a la fisura esfenorbital (Engelman, 1985). En Dasypus se ha descripto un corazón ricamente inervado. Los componentes de conducción cardíaca reciben un profuso aporte de fibras nerviosas (Bhatnagar y Qayyum, 1972). En el género Dasypus se han descripto glándulas sebáceas y sudoríparas asociadas a cada folículo piloso (Cooper, 1930) y glándulas anales de olor característico (Haynes y Enders, 1960). El estómago es simple (Grasse, 1955). Gran desarrollo del nervio trigémino y relativamente pequeño del nervio y quiasma óptico (Garrod, 1878). Órgano vomeronasal (OVN) bien desarrollado (Giacomini, 1913). La organización funcional de la corteza y otras estructuras cerebrales es poco conocido (Jakob y Onelli, 1913; Jakob, 1943; Hasting, 1970; Hasting y Martin, 1970; Royce et al., 1975; Dom et al., 1971).
¿Quién es el Sr. Chaetophractus villosus…?
El Chaetophractus villosus se distribuye exclusivamente en América del Sur (Fig. 3), habitando selectivamente en Paraguay, Bolivia, Chile y Argentina (Wilson y Reeder, 1993; Abba, 2008). Se lo encuentra actualmente hasta en Tierra del Fuego (Argentina) (Poljak et al., 2007).

Figura 3.
Foto de un ejemplar de Chaetophractus villosus denominado vulgarmente “peludo”.
En la Tabla I se detalla la clasificación taxonómica del género Chaetophractus, dentro de las especies de Armadillos según McKenna y Bell (1997).
Tabla I.
Clasificación sistemática del género Chaetophractus. C. villosus (peludo) y C. vellerosus (piche llorón) (McKenna y Bell, 1997).

El C. villosus, vulgarmente llamado “peludo”, es endémico del sur de Sudamérica y posee una de las distribuciones más amplias entre las 20 especies de armadillos actuales (Wetzel, 1982; Nowak, 1991; Redford y Eisenberg, 1992; Wilson y Reeder, 1993) (Fig. 4). Dicha distribución se extiende desde el Gran Chaco de Bolivia y Paraguay hasta el sur de la provincia de Santa Cruz y zonas de Tierra del Fuego en Argentina y en Chile hasta las provincias de Bío Bío y Magallanes (Wetzel, 1985; Tamayo, 1973; Azize Atallah, 1975; Wilson y Reeder, 1993; Poljak et al., 2007).
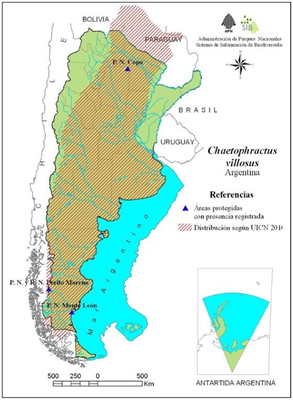
Figura 4.
Distribución geográfica de Chaetophractus villosus.
(Tomado de: Chaetophractus villosus https://sib.gob.ar/ficha/ANIMALIA*chaetophractus*villosus).
La especie C. villosus, habita una variedad de ambientes con climas y recursos alimenticios diversos. Esto lo logra debido a sus hábitos fosoriales por un lado, ya que le permite afrontar amplias fluctuaciones de temperatura ambiental (Mc Nab, 1979 y 1985); como así también a poseer una dieta poco especializada (Redford, 1985), lo que le facilita una notable capacidad de adaptación para habitar diferentes regiones. El hallazgo de esta especie en la Isla Grande de Tierra del Fuego, donde la temperatura media anual es más baja que la de Santa Cruz (datos de la Estación Astronómica Río Grande, E.A.R.G, UNLP-CONICET), es una prueba de su plasticidad adaptativa.
Deferrari et al. (2002) mencionan que aparentemente no sería el clima un factor determinante para la distribución austral de C. villosus sino la barrera de agua que constituía el Estrecho de Magallanes, similar a lo que ocurre con la ausencia de la especie en Uruguay debido a la barrera representada por el estuario del Río de la Plata.
Dada la característica de ser una especie que se distribuye en un mosaico ambiental sumamente diverso, lo que queda demostrado por su hallazgo en el extremo más austral de Sudamérica, permite plantear interrogantes relacionados con las estrategias adaptativas a ambientes tan diversos. Esta extraordinaria capacidad adaptativa y su antigüedad evolutiva hace que pueda ser tomado como un excelente modelo experimental en filogenia y fisiología de adaptación.
♦Aspecto externo
Los adultos de la especie C. villosus (peludo) miden alrededor de 50 cm de largo, distribuido aproximadamente de la siguiente forma: la cabeza, 9 cm; la caparazón del tronco, 26 cm y la cola, 15 cm (Yepes, 1928). Son levemente aplanados en sentido dorso-ventral (Fig. 3). Presentan de 6 a 8 (comúnmente 8) bandas móviles. El borde externo del caparazón posee placas triangulares en forma de dientes, que le dan un aspecto aserrado (Yepes, 1928).
Escudete cefálico es triangular, con diámetro transversal mayor que el longitudinal (típico del género). Las orejas son medianas y se ubican lateralmente.
El escudo pelviano es levemente convexo y posee 2 o 3 orificios correspondientes a los poros glandulares medio-dorsales de las glándulas pelvianas (Pocock, 1913; Fernandez, 1922), cuya secreción amarillenta posee un olor característico.
Poseen pelos cerdosos largos, en número de 2 a 12 por placa (Yepes, 1928), hasta 14 ó 15 en las correspondientes a los bordes de las bandas móviles (Crespo, 1944) implantadas en el borde posterior de las placas. Estas mismas cerdas fuertes, cubren también la superficie ventral, partiendo de verrugas óseas implantadas en la piel; la cola y las patas están también cubiertas de estas sedas, siendo ahí donde se encuentran las más largas.
Los miembros son pentadáctilos. Las uñas de los posteriores no difieren mucho en tamaño; en los anteriores, en cambio, la uña más larga corresponde al tercer dedo (Yepes, 1928).
♦Morfología interna
En el peludo se determinó que la relación ancho/longitud del cráneo es de 0,64, y la relación altura/longitud es 0,31 (Fig. 5). Algunas características morfométricas craneanas indican dimorfismo sexual, por ejemplo, largo total y ancho nasal e interorbitarios, siendo en todos los casos los cráneos de las hembras de mayor tamaño (Squarcia et al., 1993). Presenta un arco zigomático corto, aplanado transversalmente. La fórmula dentaria 9/10.
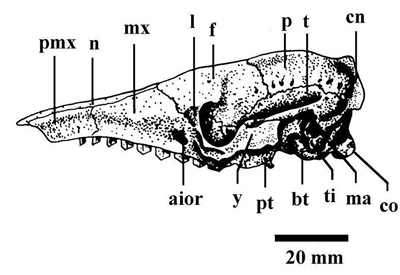
Figura 5.
Esquema en vista lateral del cráneo de Chaetophractus villosus. aior= agujero infraorbitario; bt= bula timpánica; cn= cresta nucal; co= cóndilo del occipital; f= frontal; l= lacrimal; ma= meato auditivo externo; mx= maxilar; n= nasal; p= parietal; pmx= premaxilar; pt= pterigoides; t= temporal; ti= timpánico; y= yugal (modificado de de Squarcia et al., 1993).
El estómago es simple y posee un ciego que separa al intestino delgado del grueso (Casanave et al., 1988), histológicamente responde a la morfología típica de mamífero (Estecondo et al., 1988). Poseen glándulas salivales pares, una parótida y una submaxilar, asociada, esta última, a un reservorio salivar (Estecondo et al., 1989).
La cavidad nasal es una estructura bien desarrollada y compleja (Ferrari, 1997). Ocupa el macizo facial con una dirección longitudinal, extendiéndose desde el extremo anterior del hocico hasta el etmoides -que la separa del cerebro- y la coana -que comunica con la nasofaringe. Se divide en dos fosas nasales por medio de un tabique denominado septo nasal. Sin embargo, esta división es incompleta, la cavidad nasal se halla completamente dividida en una cavidad izquierda y derecha solamente en su tercio rostral. Caudalmente, ambas están en continuidad a través del extremo ventral del septo nasal (Fig. 6).
Las narinas desembocan dentro de la cavidad nasal en una región denominada vestíbulo. La cara latero-interna presenta una estructura muy llamativa, que a modo de evaginación, oblitera parcialmente el lumen vestibular. Esta estructura se halla tapizada por numerosas espinas queratinizadas que se proyectan hacia las narinas. A partir del vestíbulo la pared lateral de las fosas nasales es irregular y anfractuosa debido a la saliencia de los turbinales -cornetes- que delimitan depresiones longitudinales llamadas meatos. Sobre estos turbinales descansa el epitelio respiratorio y la mucosa olfatoria (MO). Este complejo sistema de cornetes nasales provee una enorme superficie cubierta por las diferentes mucosas.
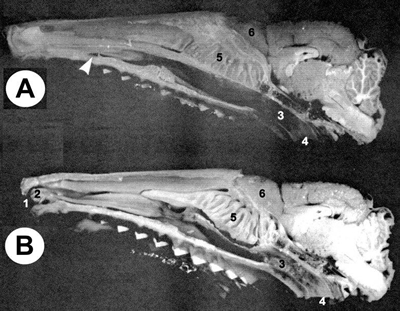
Figura 6.
Preparado de la cabeza del armadillo Chaetophractus villosus. A: corte sagital. Desde la flecha hacia rostral el septo nasal es incompleto (1,8x). B: preparado sagital luego de la remoción del septo nasal. 1= narina; 2= órgano vestibular; 3= conducto nasofaríngeo; 4= coana; 5= endoturbinales; 6= bulbo olfatorio (1,8x) (cortesía Dra. Ferrari).
La MO posee también características interesantes (Ferrari et al., 1997). Al microscopio óptico, el epitelio olfatorio presenta tres tipos celulares característicos de este tejido (Fig. 7): células de sostén, neuronas olfatorias y células basales. Al microscopio electrónico las células de sostén presentan enormes protrusiones apicales, pudiéndose tratarse de secreciones apócrinas. Como otro dato interesante, se han descripto sitios de unión de melatonina en la MO del armadillo C. villosus (Affanni et al., 2008). En Ferrari (1997) se puede encontrar un profundo estudio inmunohistoquímico y de microscopía electrónica de la MO de C. villosus.
Poseen un órgano vomeronasal (OVN) bien desarrollado (Carmanchahi, 1996 y Carmanchahi et al., 2000). Este órgano juega un rol importante en la percepción de estímulos llevados por moléculas (feromonas) y está relacionado con conductas sociales y reproductivas en muchas especies de vertebrados. Este órgano está presente en la mayoría de vertebrados terrestres, pero es ausente o vestigial en peces, algunos anfibios terrestres y aves. El OVN de C. villosus es una estructura par elongada con forma tubular, el cual se halla encerrado en una cápsula cartilaginosa dentro del extremo anterior ventral del septo nasal. En la región posterior, el tubo termina ciego. En la región anterior, el OVN se abre a la cavidad oral por medio del ducto nasopalatino o incisivo.
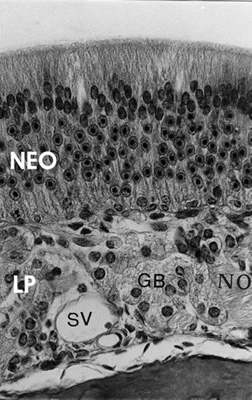
Figura 7.
Mucosa olfatoria del armadillo Chaetophractus villosus. Se diferencia el neuroepitelio olfatorio (NEO) y la lámina propia (LP). NO= nervio olfatorio, GB= glándula de Bowman, SV= seno venoso. Tricrómico de Masson (400x) (Cortesía Dra. Ferrari).
En el año 2010 describimos los pasos de un procedimiento quirúrgico para la extirpación bilateral del OVN del armadillo C villosus. Debido a que cada órgano está ubicado en el piso de la cavidad nasal, adosado a cada lado del tabique nasal, los órganos se abordan a través de una abertura practicada en el techo de la cavidad bucal (Iodice et al., 2010).
A partir de los estudios histológicos, ultraestructurales e inmunohistoquímicos del OVN del peludo, realizados por Carmanchahi (1996) y Carmanchai et al. (2000), se puede concluir que este órgano es funcionalmente activo y muy desarrollado (Carmanchahi et al., 2000). Sin lugar a dudas este animal se presta como un excelente modelo experimental de estudio para futuras contribuciones al conocimiento de la fisiología del OVN.
El C. villosus posee características anatómicas de su cerebro que lo colocan en una posición de gran interés biológico para el estudio de la estructura y funcionamiento del SNC, y con especial énfasis el funcionamiento del sistema olfatorio. Benitez et al. (1994), en el Instituto de Neurociencia (CONICET-UBA), encararon el estudio de la estructura anatómica e histológica del encéfalo de C. villosus. Sobre la base de dicho trabajo se hace la siguiente descripción neuroanatómica.
A nivel macroscópico se puede apreciar el relativo gran tamaño de los bulbos olfatorios (BO) y tubérculo olfatorio (TO) (Fig. 8). En dichas figuras también se puede observar que la fisura rhinalis anterior y posterior ocupan un posición elevada sobre la superficie lateral del los hemisferios cerebrales (HC). Se observa en la vista lateral y ventral el gran desarrollo del V par de nervio craneal, el trigémino.
 |
 |
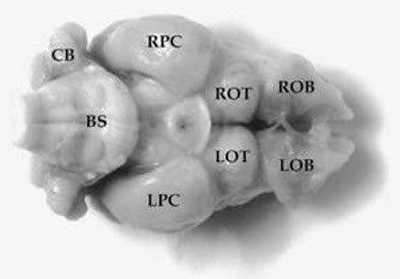 |
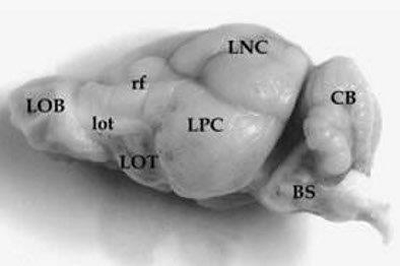
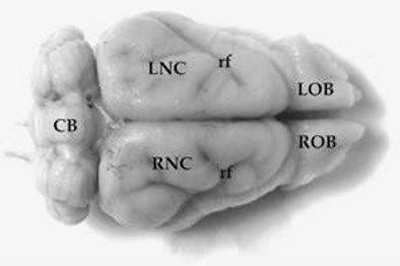
Figura 8.
Vista macroscópica del encéfalo de Chaetophractus villosus. A. Vista lateral (1,3X). B. Vista dorsal (1,3X). C. Vista ventral (1,3X). En la figura A se puede observar que la fisura rhinalis (rf) ocupa una posición elevada sobre la superficie lateral de los hemisferios cerebrales. LOB y ROB= bulbos olfatorios izquierdo y derecho; BS= tallo cerebral; CB= cerebelo; LNC y RNC= neocorteza izquierda y derecha; LOT y ROT= tubérculo olfatorio izquierdo y derecho; LPC y RPC= corteza piriforme izquierda y derecha; lot= tracto olfatorio lateral (Benitez et al., 1994).
La Fig. 9 muestra un corte sagital del encéfalo, en donde se pueden distinguir, visto en dirección rostro-caudal, el BO principal, el pedúnculo olfatorio (PO), el TO, la neocorteza (NC), la corteza del hipocampo, el cuerpo estriado, el tálamo óptico, los tubérculos cuadrigéminos, el cerebelo, la protuberancia y el bulbo raquídeo. También se pueden identificar la comisura anterior (CA), la comisura hipocampal y el cuerpo calloso.
Las terminaciones de las fibras interbulbares de la CA, que puede observarse en la región basal del encéfalo, fue estudiada por Affanni et al. (1969), en esta especie, a partir de la bulbectomía unilateral y posterior procesamiento histológico con la técnica de Nissl. En este trabajo se pudo comprobar la presencia de sinapsis axo-dendríticas y axo-somáticas como una modalidad de las terminaciones interbulbares. En animales con destrucción total de un BO y de la porción rostral del núcleo olfatorio anterior (NOA) ipsilateral, se observó en el BO contralateral la existencia de fibras y terminales en degeneración en la capa de células granulares y en la capa plexiforme interna, sin notar cambios en las restantes capas bulbares. La intensidad de degeneración observada, mostró un gradiente decreciente desde el NOA, donde fue más intensa, hasta la región más periférica de la capa plexiforme interna. Finalmente se comprobó que en C. villosus la distribución de las fibras de la CA era semejante a la del gato, estudiada por Mascitti y Ortega (1966). Es evidente, entonces, la existencia de un plan fundamental en la organización anatómica de la CA en todos los mamíferos, por lo menos en aquellos que son macrosmáticos.
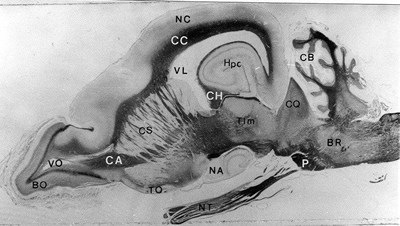
Figura 9.
Sección sagital del encéfalo de Chaetophractus villosus. BO= bulbos olfatorios; BR= b. raquídeo; CA= comisura anterior; CB= cerebelo; CC= cuerpo calloso; CH= comisura hipocampal; CPi= corteza piriforme; CQ= cuerpos cuadrigéminos; CS= cuerpo estriado; Hpc= hipocampo; Hpt= hipotálamo; NA= núcleo amigdalino; NC= neocorteza; NT= nervio trigémino; P= protuberancia; TC= tronco cerebral; Tlm= tálamo; TO= tubérculo olfatorio; VL= ventrículo lateral; VO= ventrículo olfatorio (Klüver-Barrera, 3X) (cortesía Dra. Isabel Benítez).
En una sección vertical a la altura del BO principal se puede observar un gran ventrículo olfatorio, y capas concéntricas bien delimitadas: glomerular, plexiforme externa, de células mitrales y de células granulares. La ubicación del BO accesorio (BOA) es similar al descripto en otras especies de mamíferos, y en C. villosus las células mitrales de este bulbo están dispersas dentro de la capa plexiforme externa (Carmanchahi, 1996). Affanni et al., (1969) describen la vía comisural entre ambos BO. En este armadillo el tracto olfatorio lateral (TOL) discurre dentro de la capa granular y no entre la granular y la plexiforme interna a diferencia de otras especies.
Una profunda fisura rhinalis anterior actúa como un límite entre el NC -corteza frontal- y el paleocórtex (Fig. 8). Una capa del BO contribuye al paleocórtex en su región medio-ventral, mientras que la corteza piriforme (CPi), rodeada por el TOL, forma el área dorso-lateral del hemisferio cerebral. A medida que se van observando cortes verticales más caudales, la NC domina la región dorsal y la fisura rhinal posterior la separa de la CPi, que domina la región lateral externa. El TOL sigue externamente bordeando a dicha corteza. En una región más caudal, el gran tamaño del TO comienza a predominar en la región ventral del cerebro.
En la región central de cada hemisferio cerebral comienzan a destacarse los núcleos del cuerpo estriado y el cuerpo calloso uniendo ambos lados. Sobre el cuerpo calloso predomina el induseum griseum, estructura muy conspicua en este mamífero, que se encuentra a ambos lados de la línea media. Hay dos hechos importantes: este animal muestra un estado intermedio entre lisencefalia y girencefalia (ver Fig. 8), y por otro lado el gran tamaño del núcleo amigdalino en la región ventral.
♦Fisiología reproductiva
La reproducción estacional en C. villosus fue también objeto de estudios. En los machos de C. villosus se observó que un animal que produce espermatozoides durante gran parte del año pasa a ser azoospérmico durante el otoño (Luaces et al., 2012). La espermatogénesis en C. villosus presenta un período de inactivación anual (durante el mes de mayo en la Pcia. de Buenos Aires) donde el peso del testículo activo se reduce un 75%, sufriendo una drástica regresión a través de la descamación de células del epitelio seminífero al lumen en un proceso contundente y rápido (Luaces et al., 2012). Esta rápida regresión testicular fue recientemente caracterizada molecularmente (Luaces et al., 2012 y 2014).
En las especies que presentan ciclos testiculares estacionales la actividad gametogénica es bloqueada reversiblemente durante cierto período del año. Visto así, el estudio de los mecanismos que controlan la detención del proceso de espermatogénesis podría constituir una base para el desarrollo de nuevas tecnologías que puedan ser efectivas y específicas para regular la fertilidad en los mamíferos, y como control biológico, dado su carácter reversible, procura además conservar las poblaciones viables.
Un efectivo control biológico del peludo prevé un impacto económico positivo a nivel local, ya que apunta a subsanar los conflictos que esta especie genera para la producción agrícola. Contribuyendo asimismo a evitar la matanza que hoy se practica y que va en desmedro del bienestar animal, que en muchos casos es realizada con agentes tóxicos y contaminantes para la tierra y los cultivos, y que resulta por demás ineficaz y laboriosa.
Tratando de compendiar…
Dado que las descripciones precedentes pueden resultar técnicamente complejas para los no avezados, por lo tanto, las siguientes son algunas de las características que hacen que los distintos géneros de Armadillos sean tratados con tanto interés en la investigación biomédica:
• Susceptibilidad natural a la lepra en estado silvestre (Storrs y Burchfield, 1984).
• Susceptibilidad experimental al Mycobacterium leprae por parte de otras especies del género Dasypus (Baliña et al., 1985).
• Presencia de lepra indígena y mycobacteriosis natural similar a la lepra humana (Meyers et al., 1978; Resoagli et al., 1982).
• Ausencia total de glándula pineal (Benítez et al., 1994; Ferrari et al., 1998) y gran desarrollo de glándula de Harder (Aldana Marcos y Affanni, 2005) y otras glándulas perioculares (Aldana Marcos et al., 2002).
• Implantación diferida del blastocisto (Enders, 1960; Daniel y Krishman, 1969; Storrs y Burchfield, 1989; Storrs et al., 1989).
• Baja tasa metabólica comparada con mamíferos de pesos semejantes (Wislocki y Enders, 1935; Scholander et al., 1943; Burns y Waldrip, 1971).
• Poseen temperatura corporal relativamente baja (Ozorio de Almeida y de Almeida Fialho, 1924; Enders y Davis, 1936; Mac Nab, 1980; Roig, 1971) y se encontraron dos perfiles térmicos en el C. villosus: uno con una alta variación, principalmente debido a al ciclo diario; el otro con baja variación, con no predominancia del ciclo diario (Casanave y Affanni, 1994).
• Recuperación espontánea de la fibrilación ventricular inducida por estímulos eléctricos (Szabuniewicz et al., 1970).
• Presencia de médula ósea en las placas dermales de las bandas dorsales que responde a cambios hematopoyeticos estacionales (Weiss y Wislocki, 1956).
• Poliembrionía monocigótica, ya nombrada, con conspicua estructura amniótica (Chapman, 1901; Fernández, 1909; Galbreath, 1985).
• La producción de gemelos idénticos del género Dasypus (Fig. 1) los convierte en modelos óptimos para:
o Estudios histocompatibilidad y biología de trasplantes (Anderson y Benirschke, 1962; Billingham y Neaves, 1980).
o Inmunología, biología del desarrollo y reproducción (Anderson y Benirschke, 1966).
o Herencia (Chedd, 1968).
o Interacción genético-ambiental en aprendizaje y comportamiento (Campagna et al., 1984; Papini et al., 1984).
• Ausencia de erecciones del pene durante el sueño paradójico y eventos peneanos peculiares durante la vigilia y el sueño de ondas lentas del armadillo (Affanni et al., 2001).
• Susceptibilidad a drogas teratogénicas para los humanos como la talidomida (Marin-Padilla y Bernirschke, 1963 y 1965).
• Susceptibilidad a enfermedades zoonóticas (importancia epidemiológica) como:
o Tripanosomiasis (Mazza et al., 1931; Romaña y Schürmann, 1931).
o Fiebre aftosa (Campion, 1950).
o Leptospirosis (Cacchione et al., 1966; Myers et al., 1977).
o Carbunclo y clostridiosis (Campion, 1959).
o Toxoplamosis (Schenk et al., 1976).
o Salmonelosis (Quevedo et al., 1978).
• Son eslabones de la cadena epidemiológica de diversas enfermedades de la fauna silvestre como:
o Coccidiosis (Sampietro, 1978).
o Helminto parasitosis (Lombardero, 1970; Lombardero y Moriena, 1977; Martinez y Resoagli, 1982).
o Ectoparasitosis (Martinez y Resoagli, 1982).
• Larga expectativa de vida: de 12 a 15 años (ideal para experiencias crónicas) (Walter, 1968).
• Posible respuesta inmunitaria débil (Storrs, 1971).
• Posibilidad de mantener grandes deudas de oxígeno (Scholander et al., 1943).
• Susceptibilidad a la inoculación de agentes patógenos humanos:
o Fiebre ondulante y esquistosomiasis (Storrs, 1971).
o Tifus murino y Tifus exantemático (Magalhaes y Rocha, 1944).
o Esquistosomiasis (Storrs, 1971).
• Frecuente mutaciones génicas expresadas en las placas el caparazón.
• Grandes cuerpos adrenales fetales (De Nicola y Affanni, 1971).
• Relativa facilidad para realizar hipofisectomías (Affanni y García Samartino, 1984).
Si bien esta es una enumeración sintética de gran parte de las características de la familia Dasipodidae, no todos los géneros las comparten. En lo específicamente referido al género Chaetophractus, poseen algunas otras particularidades que apuntalan nuestra propuesta como modelo experimental:
• Fácil acceso quirúrgico a diversos centros cerebrales (Affanni y García Samartino, 1984; Cervino, 1997).
• Mucosa olfatoria muy desarrollada adecuada para estudios anátomo-fisiológicos (Ferrari et al., 1988).
• Neocorteza en forma de casquete superior para fácil decortificación quirúrgica (Benítez et al., 1994).
• Gran desarrollo de estructuras olfatorias del cerebro, dando un excelente modelo para estudio del sistema olfatorio (Benitez et al., 1994).
• Gran desarrollo del OVN, dando un excelente modelo para estudio de este sistema quimiorreceptor (Carmanchahi, 1996; Carmanchai et al., 2000).
• Glándulas adrenales con alto nivel de biosíntesis de esteroides (De Nicola y Affanni, 1971).
• Particular desarrollo del tracto olfatorio y el paleocortex que permite estudiar la actividad bioeléctrica de distintas áreas del cerebro (Affanni et al., 1978; Cervino, 1997), el ciclo vigilia-sueño (García Samartino et al., 1974; Cervino 1997; Cervino y Affanni, 2010; Affanni y Cervino, 2010) y el control centrífugo de la aferencia olfatoria (Affanni et al., 1973; Cervino 1997), entre otras peculiaridades.
• Ciclos de actividad testicular estacionales (Luaces et al., 2012).
Una mención aparte lleva el estudio de la actividad bioeléctrica cerebral del peludo C. villosus durante la vigilia y el sueño, analizando la actividad de las estructuras cerebrales olfatorias: BO, TO, CPi y NC (Affanni et al., 1968; García Samartino et al., 1974; Affanni y Garcia Samartino, 1976 y 1984; Garcia Samartino, 1983; Cervino, 1997; Affanni y Cervino, 2005).
Se ha descripto la presencia en los BO (García Samartino y Affanni, 1976) de un nuevo tipo de actividad bioeléctrica, en el rango de las frecuencias (8-12 Hz): actividad Rino-Centrífuga-Génica (RCG). En Affanni y Garcia Samartino (1984), Cervino (1997) y Affanni y Cervino (2005) se describen las características y propiedades de dicha actividad en los BO, a saber: a) es característico de la vigilia relajada; b) su aparición requiere tanto de la aferencia periférica como de la central. La ausencia de alguna de estas dos acciones basta para impedir su aparición; c) este ritmo también desaparece durante el sueño.
La actividad bioeléctrica cerebral durante las fases del sueño de C. villosus fue descripta por Affanni et al., (1968), Garcia Samartino et al. (1981); García Samartino (1983) y Cervino (1997). Se descubrió experimentalmente la presencia de un tipo peculiar de actividad eléctrica sinusoidal en las áreas rhinencefálicas, durante las fases de sueño, en ausencia de aferencia olfatoria periférica (Affanni et al., 1977; Affanni y Garcia Samartino, 1984; Cervino, 1997; Affanni y Cervino, 2005): actividad hípnica Reo-Privo-Génica (RPG). Recibe este nombre porque aparece durante el sueño de ondas lentas y el sueño paradójico en animales con destrucción de la MO o con supresión de la corriente aérea nasal.
También, se ha demostrado que la ablación bilateral del OVN en el armadillo determina la aparición de las ondas gamma de alta amplitud en BO, TO y CPi durante el sueño paradójico (Affanni y Cervino, 2001 y 2004; Affanni et al., 2012).
A modo de conclusión…
En los últimos años se ha venido manifestando un creciente interés científico por algunos mamíferos de la fauna americana. Este interés es provocado por el sorprendente hecho de que ciertos edentados del Nuevo Mundo ostentan un numeroso elenco de importantes propiedades que los están convirtiendo en modelos de inapreciable valor para la investigación científica.
Por lo dicho hasta aquí, es evidente que los Armadillos han sido y son ampliamente utilizados como modelos experimentales en diversas áreas de la investigación biomédica. Esto se debe a que poseen particulares características anatómicas, fisiológicas y comportamentales. Ya que no solo se han publicado trabajos experimentales referidos a aspectos anatomofisiológicos, neurofisiológicos y reproductivos; sino que también pueden encontrarse reportes en los que han sido utilizados como modelos en Psicología Comparada (Campagna et al., 1984; Papini et al., 1984).
Durante los últimos 20 años se produjeron significativos avances en biología molecular y celular que mejoraron la comprensión de la fisiología y las patologías humana y animal. La investigación biomédica se encuentra ahora en una nueva era que intenta trasladar lo que se adquirió como conocimiento básico hacia una mejor prevención, diagnóstico y tratamiento de innumerables enfermedades.
Este tipo de investigación necesita cada vez más de los modelos animales y algunos se han vuelto cada vez más sofisticados. El desarrollo y uso de animales transgénicos ha aumentado rápidamente en los últimos 7 a 10 años.
Muchos de estos animales, debido a sus particulares biotecnológicas, requieren un intensivo monitoreo de sus características sanitarias y genéticas, un alojamiento complejo y acorde a dichas características y unos cuidados sumamente especiales.
El desarrollo de esta onerosa tecnología y la capacitación del personal adecuado requerirán inversiones cada vez más difíciles de encarar por muchos países e instituciones.
Todas estas variables demandarán una inversión económica realmente incalculable, que ampliarán cada vez más la brecha entre quienes tengan dinero suficiente para invertir y quienes no lo tengan.
Cabe preguntarse si una estrategia superadora para las instituciones y estados en desarrollo no será la de compensar las costosas tecnologías de punta con originales modelos experimentales. En este contexto, los modelos biológicos no tradicionales cobran una importancia insoslayable y una trascendencia insospechada.
Bibliografía (Click aquí)
Autores:
• Omar Héctor Iodice
Médico Veterinario. Doctor de la Universidad de Morón
Profesional Principal Conicet. Instituto de Fisiología y Neurociencias (IFiNe). UM.
Docente de la Facultad de Ciencias de la Salud - UM
oiodice@unimoron.edu.ar
omariodice@gmail.com.ar
• Claudio O. Cervino
Doctor en Ciencias Biológicas. Fac. Cs. Exactas y Naturales. UBA.
Profesor Titular de Fisiología. Facultad de Ciencias de la Salud y Facultad de Ciencias Exactas, Químicas y Naturales. Universidad de Morón.
Director del Instituto de Fisiología y Neurociencias (IFiNe). UM.
ccervino@unimoron.edu.ar
• Lugar de trabajo:
Instituto de Fisiología y Neurociencias (IFiNe). Universidad de Morón.
Machado 914, 1° Piso. Morón. (B1708JPD). Bs. As. Argentina.
Teléfono: (54-11) 5627-2000 Interno 740.


















Comentarios